第十章 选择检验程序
要求:
实验室应选择满足用户需求和要求并适于所做检验的检验程序。
- 美国实验室所用的检验程序几乎都经过美国FDA的批准;
- 日常操作受 CLIA 法规监管;
厂商数据必须与他们声明的性能(包括精密度、正确度或偏移、可报告范围、参考范围、检出限和干扰等)一致。
问题点:
不要求不同检验程序给出相同结果。
较好做法:由实验室确认方法性能是否满足预期用途要求的质量。
问题点:
不同检验程序结果间的可比性。
在样品具备互换性的前提下,EQA和PT计划可提供可比性的度量。
通过溯源至参考测量程序和参考物质证明正确度。
溯源性的定义: 通过一条具有规定不确定度的不间断比较链,使测量结果或测量标准的值能够与规定的参考标准,通常是与国家标或国际标准联系起来的特性。 溯源性是使不同方法和不同实验室间的检测结果具有可比性的关键,它取决于实验室使用的校准品在赋值时厂商所用的参考方法和参考物质。 ISO15189要求实验室“记录校准标准的计量溯源性”,作为检验程序技术文件的组成部分。虽然CLIA计划并无任何可比性要求,美国实验室仍应关注相关的ISO指南。
方针:实验室应选择可溯源至参考测量程序、认证参考物质或达到预期用途要求质量,且公认实现一致化的程序的检验程序。
- 国际计量委员会 (CIPM)
- 国际计量局 (BIPM)
- 医学溯源联合委员会 (JCTLM)
过程:在选择检验程序的过程中,实验室应确保分析系统厂商提供了证据,证明检验程序的校准可溯源至参考测量程序、认证参考物质或公认的一致化程序。
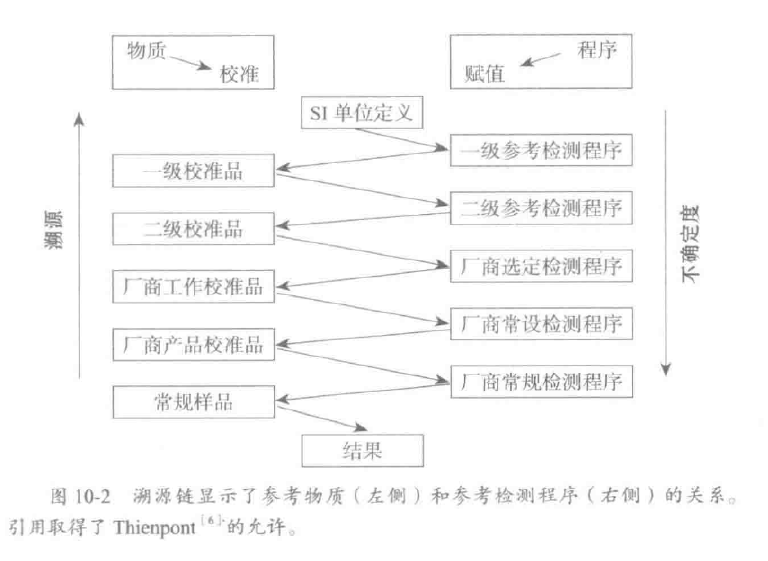
- SI 单位的定义
- 一级参考测量程序
- 一级校准品
- 二级参考测量程序
- 二级校准品
- 厂商选定测量程序
- 厂商工作校准品
- 厂商常设测量程序
- 厂商产品校准品
- 用户常规测量程序
不确定度是对溯源链质量的度量。
溯源性和可比性的5种模式:
模式I:具有SI单位定义和完整的参考检测程序和物质;
模式II:具有国际约定参考检测程序和国际约定校准品;
模式III:具有国际约定参考检测程序和厂商工作校准品;
模式IV:具有国际约定赋值方案和厂商选定检测程序;
模式V:具有厂商选定检测程序和厂商工作校品。
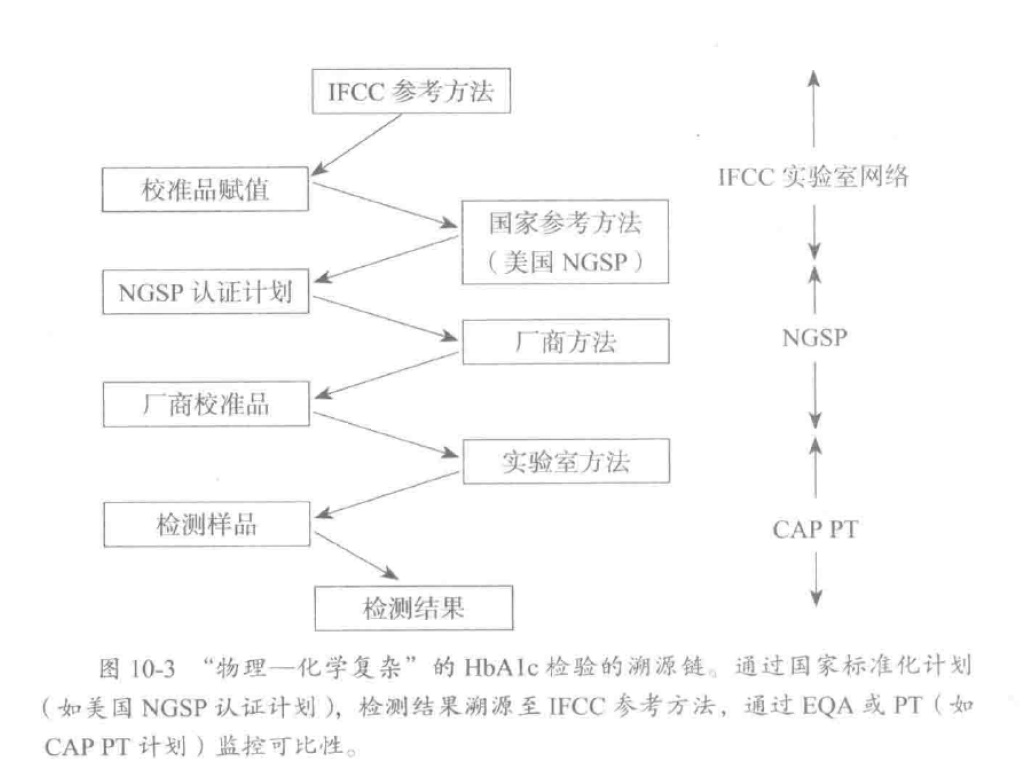
通过模式II到V可建立“医学溯源性”,以保证分析过程的可比性,及检测结果可根据通用判断标准做出解释,鉴于医学溯源情况的日趋复杂和困难,有必要持续评估以保证溯源性。
过程:在选择新的检验程序时,根据厂商声明的精密度和偏移,或公开发表的性能研究数据,计算西格玛度量值,以评估其性能能力。
程序:用公开发表的性能数据计算西格玛度量值
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E7%AB%A0-%E9%80%89%E6%8B%A9%E6%A3%80%E9%AA%8C%E7%A8%8B%E5%BA%8F/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.