第十四章 何为外部质量评估
问题
- 外部 QC 与内部 QC 有何区别?
- 实验室为何要参加能力验证计划?
- 为何要参加对等比对计划?
- 对等比对计划与能力验证计划检测的样品有何差异?
- 报告的信息有何差异?
- 何为“符合要求”的能力验证事件?
- 何为“成功”的能力验证性能?
注:对等比对,即比对,室间比对。
外部质量评估
内部 QC 是把实验室的性能与其过去进行比较,假设过去观察到的性能代表正确或准确的检测结果。这一假设应在开始时通过方法确认实验予以确认,并且必须通过“外部质量评估计划”进行持续的确认。
介绍 SQC 原理的 CLSIC24 – A3 文件 1 推荐实验室参加 EQA 计划:
9.0 实验室间 QC 计划
外部质量评估的定义
多个标本周期性地发送到实验室进行分析和(或)鉴定,将每一实验室的结果与同组的其他实验室的结果或指定值进行比较,并将比较的结果报告给参与的实验室。
实验室为何需要外部质量评估
通过计算最近的控制结果的均值、SD 和 CV, 实验室可以方便地确定他们方法的精密度。因此,只要从足够的时间期限内取得足够的数据,就能得到精密度性能的可靠评估。
但持续地确定方法准确度则要困难很多!实验室需要将检测结果与真值或正确值比较。通常将其他确定的实验室方法的结果用作近似的“真值”。
对等比对与能力验证有何差异
在美国,实验室参加对等比对计划是自愿的,而能力验证计划是 CLIA 法规要求的。在其他国家,外部质量评估计划会综合对等比对计划和能力验证计划的特点。
对等比对计划使用实验室收集的常规 QC 数据,每个月经常有成百上千的数据。当然,实验室必须检测完全相同的控制品,必须采购自同一厂家或供应商。
对等比对计划如何运作
多数控制品厂家均能为采购其控制品的实验室提供对等比对服务。由检测相同批号控制品的实验室组成对等组,每个实验室常规检测控制品并将数据提交给厂家进行统计分析。厂家随后提供报告,展示每个实验室与对等组均值或由参考方法确定的靶值比较的情况。根据计划的具体情况,数据和报告可能以纸质形式、计算机可读格式或直接通过互联网发放。
对等比对的结果是如何报告的
当下的趋势是通过互联网快速提供报告。过去需要完成所有数据处理后才能提供纸质报告,这通常需要数周甚至数月的时间,使得对等比对结果在实验室得到报告之前就已经过时了。今天,数据可以通过电话线或直接在互联网上传输,数据提交的间隔可以短于 30 天,并可立刻分析,随时报告。
标准差指数 SDI
$$ SDI = (实验室均值-组均值)/组;SD $$
CV 指数 CVI
$$ CVI = 实验室 ; CV / 组 ; CV $$
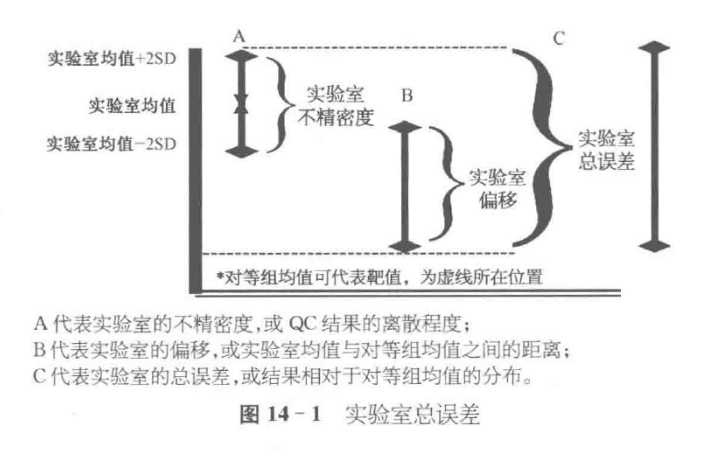
总误差
总误差代表了方法观察的系统误差(偏移, bias)和随机误差(不精密度)之和。
为了综合评估偏移和不精密度,必须使用相同的单位,通常使用%, 不精密度以 CV 表示即可。
而方法的偏移则需按如下公式转换为百分值:
%偏移=(实验室均值一组均值((100)/组均值
然后,计算总误差:
总误差=%偏移+2CV
总误差代表了“最坏情况”下的误差,即当方法的偏移与不精密度所致的误差在同一方向时的预期最大误差。
能力验证(PT)计划如何运作
在美国,根据 CLIA 法规要求,实验室必须参加能力验证。实验室可以在十多家 PT 提供者中选择和注册他们的计划。典型做法是,PT 提供者每年发放 3 次标本,每次包括一组 5 个未知标本。
实验室以检测患者标本同样方式检测这些标本,通常每个标本只能检测 1 次。然后,将检测结果提交给 PT 提供者进行统计分析和评分。正确值或靶值可以是组均值;或在某些情况下,由参考方法或一组参考实验室确定。使用联邦公报中规定的 CLIA 可接受指标,由靶值计算出可接受结果的范围。
对等比对还是能力验证计划
外部质量评估的目的是评估实验室间和方法间检测结果的差异。从这些计划得到的最重要信息是与实验室方法有关的偏移或准确度。实验室期望的结果是保持和(或)改进所用方法的准确度。在 CLIA 颁布之前,外部质量评估计划以教育为主,旨在改善实验室的性能。
随着 CLIA 的颁布,所有进行中等复杂度检测的实验室必须参加能力验证计划。遗憾的是,能力验证的监管属性给其原有的教育属性蒙上了阴影。而对等比对计划则可专注于教育与改进。
一个大型实验室是否参加某个对等比对计划通常被认为是非强制的。许多大型实验室认为由此增加的工作量超过了它带来的好处,因为他们保有的多个方法为内部比对提供了基础。大型实验室还可能条件通过有参考物质和参考方法来保持其方法的准确性。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E5%9B%9B%E7%AB%A0-%E4%BD%95%E4%B8%BA%E5%A4%96%E9%83%A8%E8%B4%A8%E9%87%8F%E8%AF%84%E4%BC%B0/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.