第十八章 何为正确的质量体系
目标
- 回顾 CLSI 质量体系要素(QSEs)
- 回顾 ISO15189 对于检测程序和分析质量保证的技术要求
- 认识将风险分析用于分析 QC 计划与质量体系的新兴指南的潜在影响
- 确定建立分析 QC 计划与质量体系过程的步骤
问题
- 什么是分析质量管理必须考虑的其他要求?
- 什么是过程控制的广泛要求?
- 什么是 ISO 的“技术要求”?
- 溯源性如何依赖于分析方法的选择?
- 方法确认在建立分析质量体系的过程中充当何种角色?
- 何为风险分析?
- 风险分析在建立分析质量体系的过程中充当何种角色?
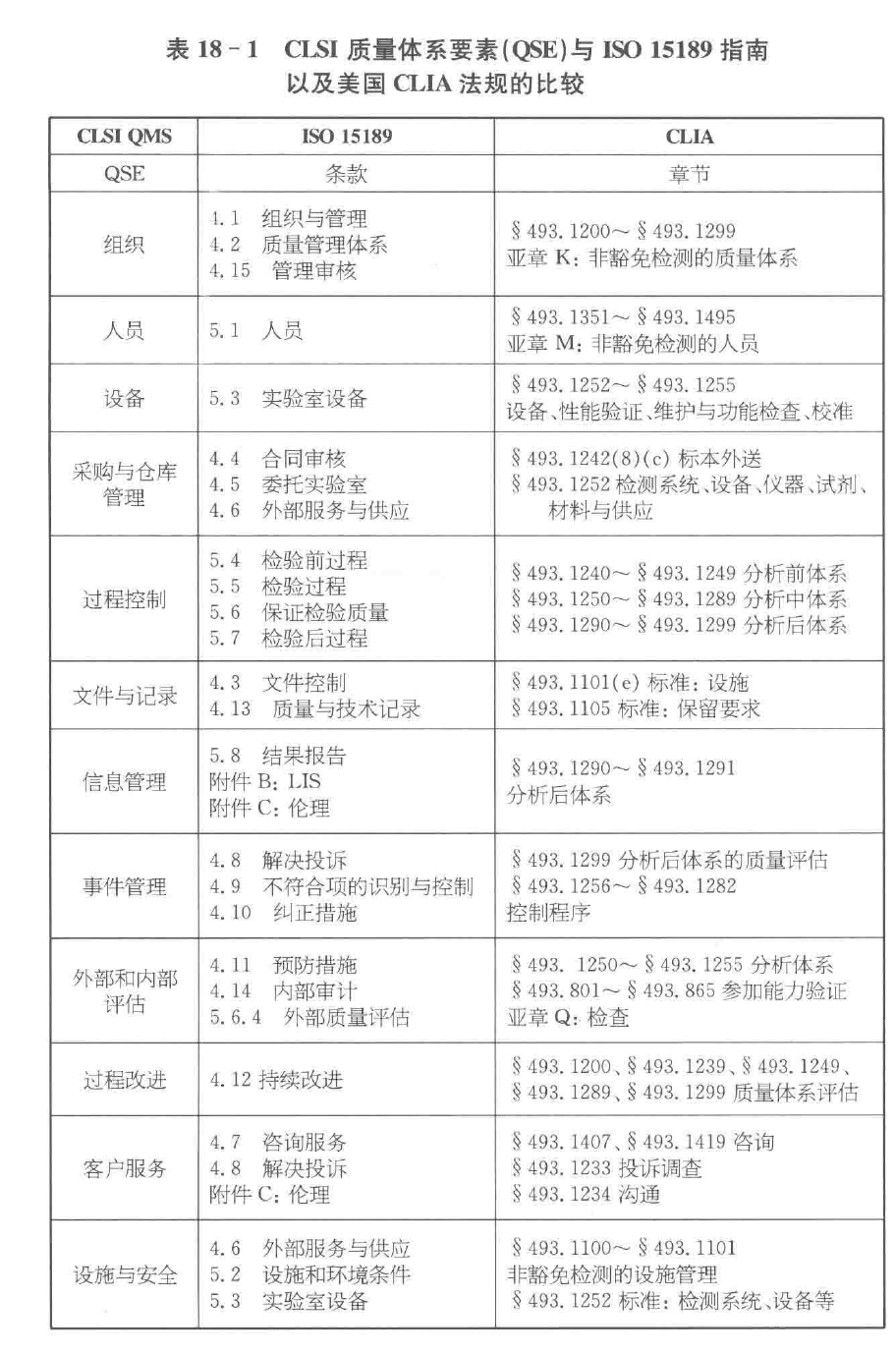
CLSI 质量体系要素(QSE)与 IS015189 指南以及美国 CLIA 法规的比较
何为质量管理体系
必要的技术要求
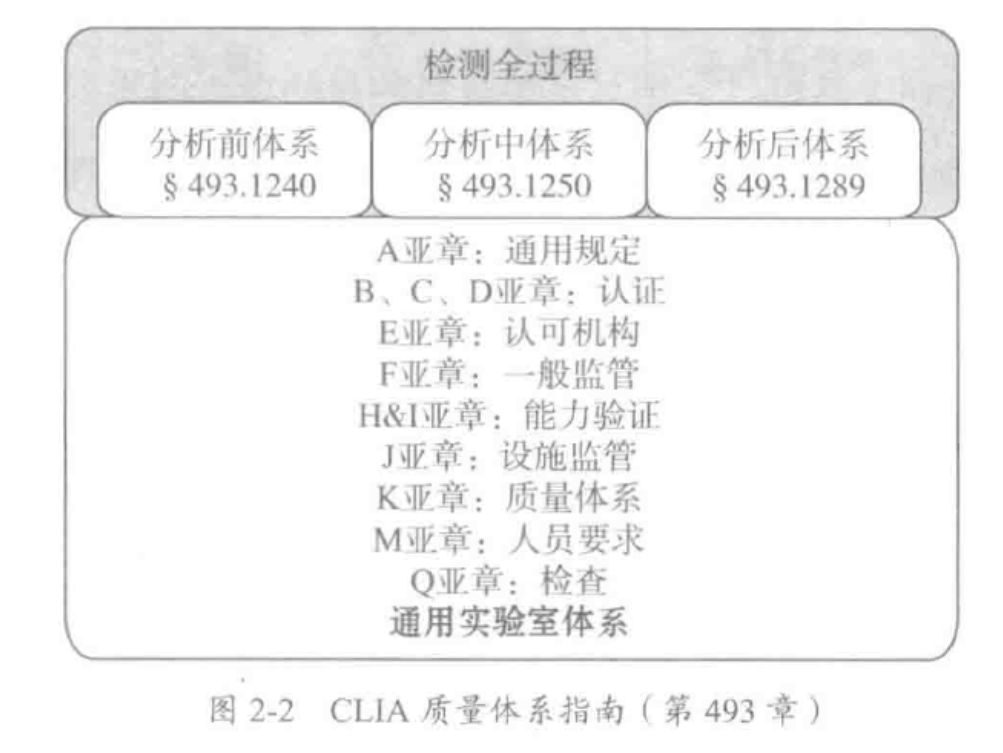
- 5.1 人员。
- 5.2 设施与环境条件。
- 5.3 实验室设备。
- 5.4 检验前程序。
- 5.5 检验程序。
- 5.6 保证检验程序的质量。
- 5.7 检验后程序。
- 5.8 报告结果。
纠正措施与质量改进
- 4.9 不符合项的识别和控制
- 4.10 纠正措施
- 4.11 预防措施
- 4.12 持续改进
风险管理
标准 ISO 22367 则推荐运用风险分析来满足这些要求:
- 若有井然有序的信息为基础,即可对预防与纠正措施予以更有效的指向;分类体系与风险分析即是提供有序信息的两个过程。
- 实验室不符合项、错误和事故的分类,有助于监控目标并允许实验室确定其临界值,设定处理它们的优先次序,并识别导致误差的潜在诱因。
尽管 ISO 15189 中并未正式提出风险管理的要求,ISO 22367 中却提供了风险分析的应用指南,并将其作为质量管理体系的组成部分。相应地,ISO 22367 遵循了 ISO 14971 中将风险管理用于体外医疗器械的通用指南。
风险分析如何影响分析 QC 计划与质量体系
建立分析质量体系
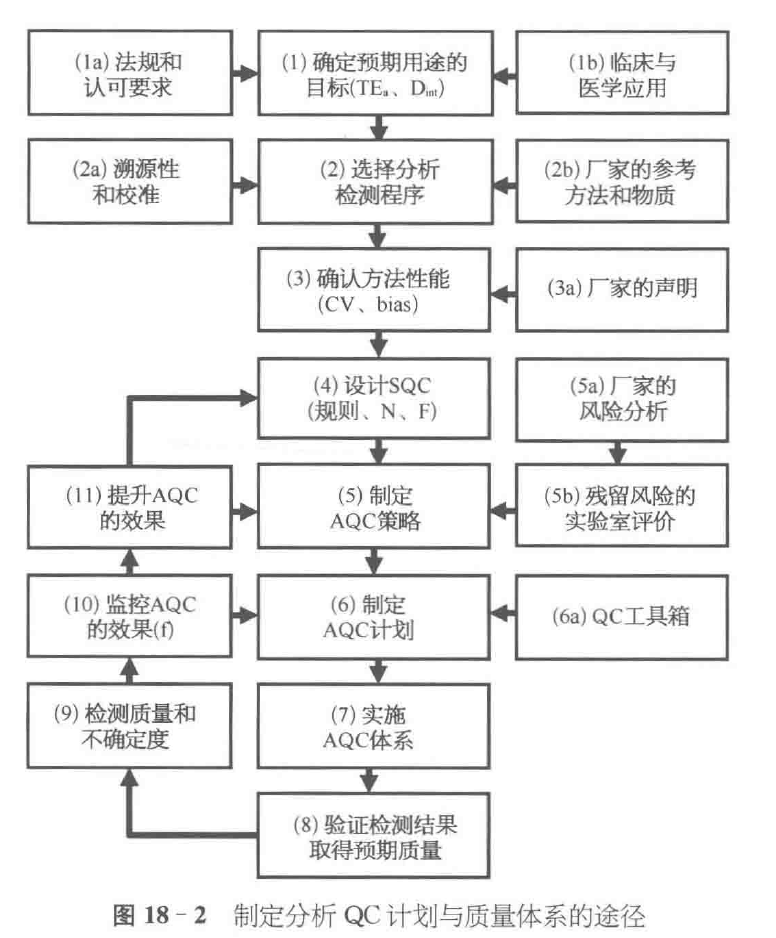
- 评估精密度(不精密度)(CV)、准确度(不准确度)(bias)
- 评估:方法对于预期用途的可接受性,判断其性能是否与厂家声明的一致;
- CLIA 要求:精密度、准确度、可报告范围及参考区间;分析灵敏度(检出限)、分析特异性(干扰与回收率)【Precision、Accuracy、Reference range、Reportable range】+【Analytic Sencitivity、Analytic Specificity】
工具
- 西格玛度量值 QC 选择工具;
- 操作规范图(OPSpecs);
- Westgard QC 程序。
目的
选择:
- 正确的控制规则;
- 正确的控制检测次数;
- 控制检测的频次;
在考虑各个项目要求的质量,以及方法实际的精密度与偏移的基础上,个性化的设计 SQC。
控制品的分析频率取决于许多可影响检测过程稳定性的因素、对问题的易感性,以及实验室运行的成本效益。
AQC (质量控制分析) 策略
- 获取风险评估信息;
- 实验室评价;
- AQC 计划;
- 确认必须监控的剩余风险因素;
- 实施 QC 程序;
- 验证检测结果是否达到了预期质量;
- 评价常规检测过程的质量与性能;
对 AQC 计划效果的监控则通过 EQA 和 PT 计划、质量指标、不符合项、投诉和事故等,尤其要确定不同原因导致的误差发生频率,然后针对这些原因予以排除,或为这些来源确定更好的 QC 监控。
最后,残留误差频率的信息将有助于进一步优化 SQC 的设计、AQC 的策略以及 AQC 的计划。
SQC 的设计、AQC 的策略以及 AQC 的计划都不是一成不变的!步骤 9~11 的循环使得分析质量控制体系自身即可以进行持续的适应与改进。
总结
Pre-QC:
分析质量体系明确了前 QC(pre-QC)要素,如分析方法或检测程序的精心选择与仔细确认。
QC:
QC 本身还会受到医学实验室在不同情况下运行不同分析系统出现潜在风险的影响。因此,一套全面的分析 QC 计划包括了 SQC 与其他仪器和实验室的控制机制。 SQC 程序的正确设计对于考虑多种误差来源的残留风险非常关键。
Post-QC:
后 QC(post-QC)要素是对质量的监控和评估,以识别问题并做出改进。实验室必须建立质量体系,以满足他们自己的检测过程特性的需求,以及他们的客户对质量的要求。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E5%85%AB%E7%AB%A0-%E4%BD%95%E4%B8%BA%E6%AD%A3%E7%A1%AE%E7%9A%84%E8%B4%A8%E9%87%8F%E4%BD%93%E7%B3%BB/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.