第十三章 制订全面质量控制计划 part 1
控制计划拓展至涵盖检验全过程,形成全面质量控制计划(TQC)
TQC 计划可通过应用风险管理原理,概念和工具来制定。
ISO 14971 为医疗器械厂商在策划和建立新分析系统时应用风险管理技术提供了指南。
CLSI EP23-A : 质量控制计划(QCP):
“一份描述实践,资源和特定活动顺序的文件,目的是控制特定检测系统或检测过程的质量以保证满足预期用途要求。”
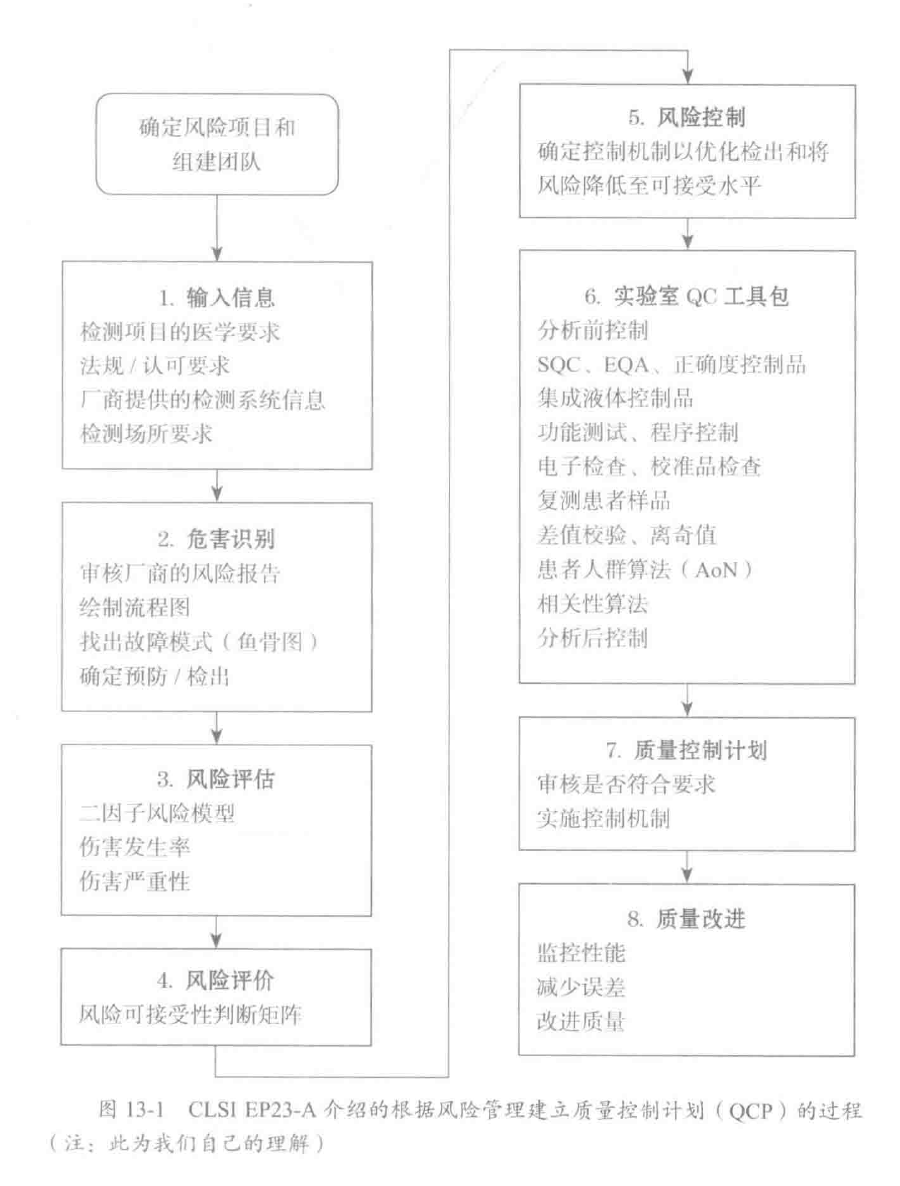
D0:确定风险项目和组建团队
- 输入信息
- 危害识别
- 风险评估
- 风险评价
- 风险控制
- 实验室 QC 工具包
- 质量控制计划
- 质量改进
在美国,CLIA 法规允许实验室实施实施“个性化质量控制计划(或简称 IQCP)”,作为依从法规对质量控制要求的一个选项。美国的认可机构,如 TJC、CAP、A2LA 及 COLA 等可能将类似要求作为检查实验室合规情况的组成部分。尽管 IQCP 选项早在 2014 年即已启用,但安排了为期 2 年的“教育和过渡期”,在此期间实验室若未从 EQC(等同 QC)转为 IQCP 不视为违规。请记住,只要实验室依从了 CLIA 的最低“默认”规定,即为检验程序每天检测 2 个水平控制品,就无需考虑“IQCP”。鉴于风险管理的实践和程序有一个艰难的学习过程,建议实验室在实施 TQC, QCP 或 IQCP 时先考虑满足默认要求。
6$\sigma$ 方针:
实验室应制定全面质量控制计划(TQC 计划)以保证检验全过程的质量,并规定每天检测至少 2 个水平控制品。
在风险管理概念刚引进医学实验室之时,强调“每天至少检测 2 个水平控制品”是一个重要管理策略、SQC 为检验程序提供了一种通用控制.可发现许多可导致检测结果错误的各种问题。但是,仅靠 SQC 无法检出所有误差情况。TQC 计划的优势在于为特定目的叠加了其他控制机制。如检查样品有无脂血、黄疸和溶血情况。检出可导致检测结果无效的样品情况是重要一步,可由分析人员进行肉眼控制,或通过分析仪的比色计进行控制。与此相似,审核检测结果找出危急值是检验后过程的重要控制。既为确认检测结果,也为了尽快发放检测报告。
对于医学实验室,固然需要着了应用风险管理技术,但依然应该遵循分析质量管理的基本要求、风险管理并不能取代这些工作:根据溯源性和性能选择检验程序,根据预期临床用途确认检验程序的性能.设计计 SQC 程序以证实取得了检测结果的预期质量一风险管讲应建立在这些基础实践之上,用于解决特殊问题或处理特定故障模式。
6 $\sigma$ 过程:
实验室应根据检验程序的西格玛性能文件和检验全过程的潜在故障模式,确定运用 TQC 计划中的各种控制机制的优先级。
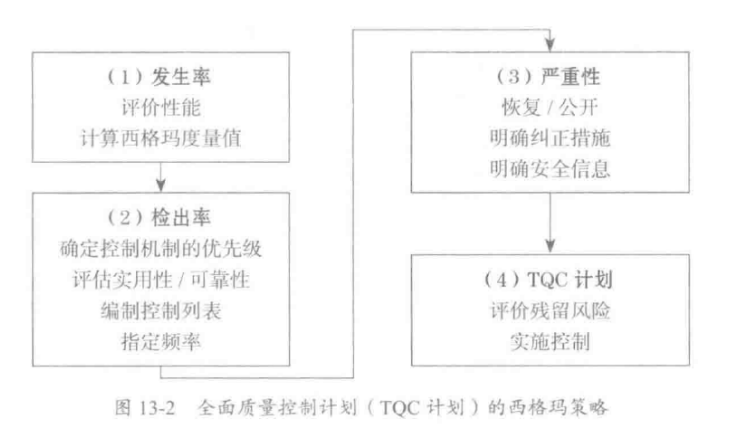
应对:
- 发生率(OCC)
- 严重性(SEV)
- 检出率(DET)
这三个因子进行评价。
一般,每个因子用 1~10 的尺度进行评价。
$$ RPN= OCC \times SEV \times DET $$
- 优先降低发生率;
- 其次是检出率
- 最后是严重性
安全设计
消除故障模式,减少发生。
安全使用,使用错误,警告,⚠️️,解决严重性问题
for 严重性:设计质量保证
- 恢复/公开
- 明确纠正措施
- 明确安全信息
for 发生率:质量管理体系策划,预防措施,体系设计,过程设计;
- 评价性能
- 计算西格玛度量值
for 检出率:质量控制:质量改进。
- 确定控制机制的优先级
- 评估实用性 /可靠性
- 编制控制列表
- 指定频率
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E4%B8%89%E7%AB%A0-%E5%88%B6%E8%AE%A2%E5%85%A8%E9%9D%A2%E8%B4%A8%E9%87%8F%E6%8E%A7%E5%88%B6%E8%AE%A1%E5%88%92-part-1/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.