第十七章 如何在实际作中改进质量 Part 2
第二部分:技术要求
常见的缺陷:
- 设备验证
- 质量要求(根据每项检验程序的预期用途)
- 验证和/或确认检验程序性能
- 内部统计质量控制策划
- 实施和监视策划的内部统计质量控制
- 分析和监视参加外部质量控制评估计划和/或能力验证计划的结果
- 评定测量不确定度
- 监视检测程序的性能
1. 设备验证
供应商选择:实验室在考虑引进新分析平台时,必须首先确定关键性能,并在选择过程中对其进行评价。实验室必须明确设备的预期用途,并规定适当功能和操作规范。当然,还要充分考虑经济和实际因素,在理想性和可行性之间做好平衡。
常见问题
如前文提及,有些实验室已经建立了质量管理体系。此种情况下,这些实验室很可能已经建立了合格供应商名单。也可能发生在他们开始寻找供应商之时,他们必须对一家或多家潜在供应商进行重新评价和分级。
在许多国家,大厂商常通过经销商提供产品,这为获取必要信息做出知情决策增加了很大难度。
在实验室申请认证时,应已安装了所有或多数设备并运行良好;因此实验室更多需要为将来的新进设备虑这些方针,而不是那些已经安装好的设备。
设备验证:这是一个记录的过程,通过此过程验证设备的恰当安装和操作,也就是说,实验筌必须保证根据厂商建立的方法正确安装了仪器,且在厂商规定的工作条件下运行(操作手册)。
设备验证包含三个不同阶段:
a. 安装验证
在此阶段必须确定收到的仪器与其设计和参数表一致,进行了正确安装,且符合其运行要求。
b. 操作验证
在此阶段必须证明仪器的运行符合操作规范(临界点的校准/验证)。
c. 性能验证
在此阶段必须证明仪器的运行符合常规操作规范(检测近似常规样品物质的性能)。
常见问题
最常见的问题是实验室缺乏正确安装了仪器的文件。
照例,被评估供应商应在安装时验证了仪器性能,问题主要在文件化上。技术服务订单常是实验室保管的唯一记录,仅说明仪器已被正确安装。实验室必须建立设备验证不同阶段的文件和记录。
因此,需要立刻行动,将设备的正确安装文件化(只有技术服务订单是不够的)。
许多时候,我们会努力联系厂商和/或经销商来补充缺失的信息,虽然并不总是可行。但这只是一个暂时的问题。尽管将实验室已有仪器文件化是个难题,但在将来可以避免这些问题。
实验室应要求设备供应商提供所有需要的文件和记录,以证明进行了正确安装,这一点很重要。事实上。这个问题甚至会影响到对供应商的选择。
推荐由质量管理员与检测部门的负责人一起监视验证过程,并保证在供应商结束安装之前收到了正确的文件和记录。
我们也看到了一些可喜现象。有些厂商和经销商已可提供贯穿设备验证不同阶段产生的所有文件和记录。此信息深受实验室赞赏,也是选择新设备时应考虑的一个关键问题。
在我们完成的每一家实验室认可中,我们都曾努力解决这一问题,提供实践培训,与厂商、经销商和实验室建立有效的沟通渠道。
2. 质量要求
前文(“确定质量")中讨论过这个话题,明确要求每个实验室必须考虑检验程序的预期用途,并为每个检验程序选择质量要求。重要的是,每个检验程序依赖于质量要求。
常见问題
在我们与许多不同国家实验室的合作经历中,多数实验室没有确定检验程序的质量要求。 这个问题是个巨大且关键的差距,因为质量要求(根据检验程序的预期用途来选择)在技术要求实施过程中极为重要:确定结果的临床应用,设计内部质量控制,评估外部质量评估计划和/或能力验证计划的报告,定期监视检测程序(如用西格玛度量)。
尽管差距巨大,但解决起来很简单,且可以快速实施。我们通常首先培训实验室操作层面的员工,每个检测部门的负责人,质量管理员和实验室经理,使他们理解质量要求的需要。我们会提供质量要求的不同选项、标准和来源。
在实施的第一阶段,许多实验室会为临床化学、血液学和血栓与止血的检测程序选择 CLIA(临床实验室改进修正案)的质量要求,而为激素、肿瘤标志物和免疫学选择 RCPA(澳大利亚皇家病理学家学会)的质量要求。
实验室常常需要对选择的质量目标取得一致意见;这个过程有时会很复杂,因为可用的标准来不止一个。 一旦确定了质量要求,我们将保证所有部门知晓它,管理层接受它,并且在工作场所能方便地查到它。
3. 验证和/或确认检验程序性能
我们在简介中提到,许多实验室认为检验程序的分析质量应由厂商保证。
每当我们启动一个认可项目,我们都会想方设法改变实验室的这种想法。大多时候,我们发现实验室根本没有确定质量要求,也从未考虑过验证或确认他们所用的方法。
评价一个检验程序,意味着要使用统计工具(方法)确定它的误差。一旦我们知道了每一种误差类型的大小,就可以将它们与厂商在用户手册或包装说明书中声明的性能指标进行比较(检验程序验证),或将它们与某个规范或质量要求进行比较(检验程序确认)。
确认/验证——误差评估——随机误差,系统误差。
结果的临床应用。
| 误差类型 | 相关概念 | 统计量 |
|---|---|---|
| 随机误差 | 精密度 | CV、SD、方差 |
| 系统误差 | 正确度 | 均值、偏移 |
| 总误差 | 准确度 | 总误差 |
误差类型、相关概念和统计量
实验室还应懂得何时适用验证或确认检验程序。
在许多情况下,进行方法验证即可;但是,我们强烈建议,一旦完成了临界性能参数的初始验证,实验室应综合这些信息评估检测程序的总误差,并基于根据检验程序预期用途选定的质量要求评价性能是否可以接受。
一旦完成初始验证之后,即可用西格玛度量值判断检验程序的性能。
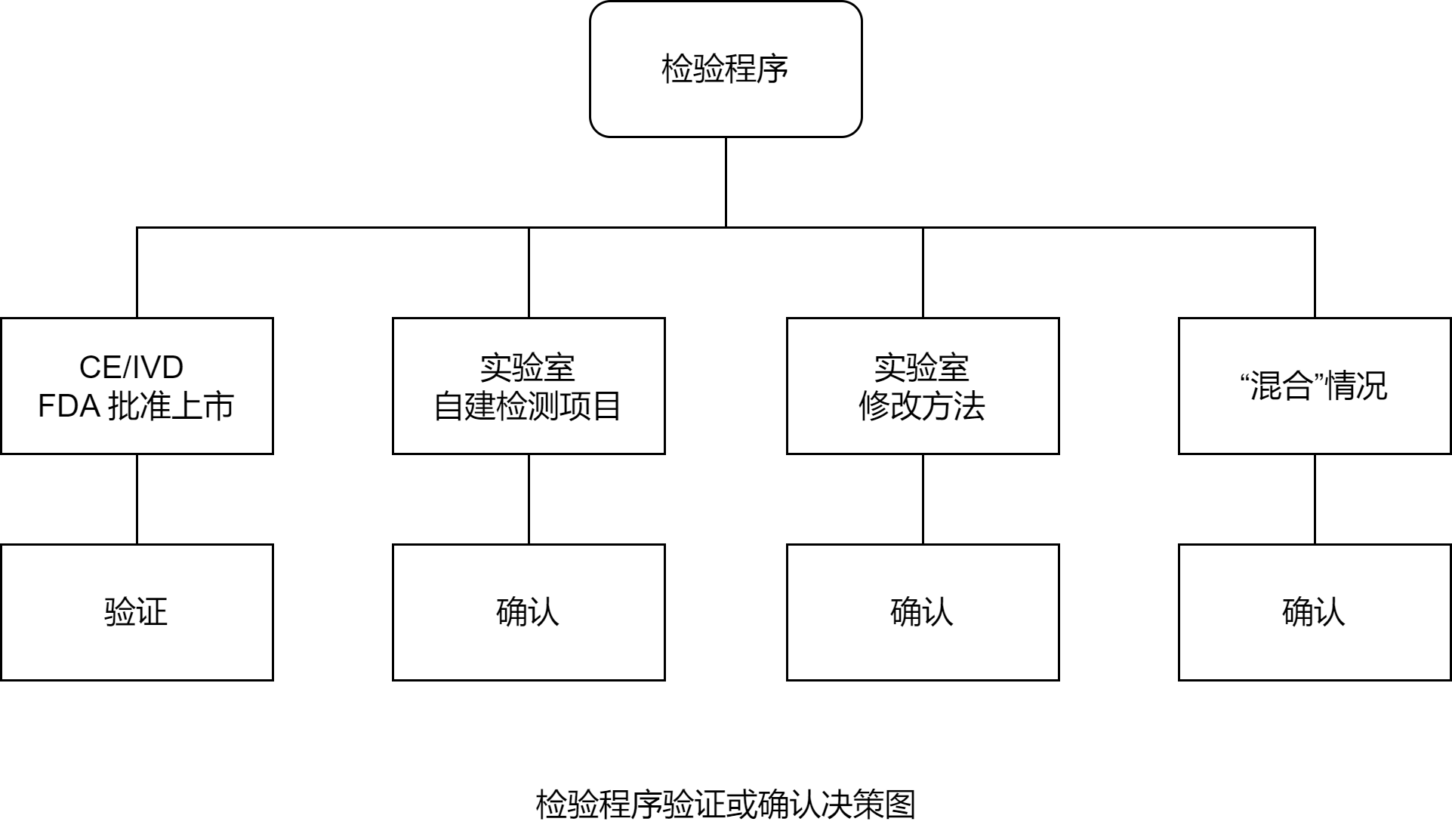
尽管要求并不一致,但应对定量和定性检验程序的许多临界性能参数进行验证已是业内共识。
定量检验程序的验证框架:
| 建立参数 | CLSI 指南(方法) |
|---|---|
| 重复性条件下的精密度 | EP 15-A2 |
| 中间精密度条件下的精密度 | EP 15-A2 |
| 准确度 | EP 15-A2 |
| 分析范围(线性) | EP 06-A |
| 定量限值(适用时) | EP 17-A2 |
| 参考区间(适用时) | EP 28-A3C |
定性检验程序的验证框架
| 建立参数 | CLSI 指南(实验方案) |
|---|---|
| 重复性条件下的精密度 | EP 15-A2 |
| 中间精密度条件下的精密度 | EP 15-A2 |
| 诊断灵敏度 | EP 12-A2 |
| 诊断特异性 | EP 12-A2 |
常见问題
如我们在前文提及,实验室无需经常进行方法确认或验证。当实验室进展到实施阶段时,应当己经建立了质量要求和明确规定了认可范围。当我们开始项目的本阶段时,我们会从 EP15-A2 实验方案开始,培训所有参与人员。
我们强调,大多情况下,只需对实验室已经安装和常规运行的检测和仪器进行评估,只在个别情况下认可过程会和新分析系统的安装同时发生。关键要在实施指南之前就策划好需求。应选择合适的样品,确保正确解释统汁量。负责处理常规样品的人员应负责选择用于验证的样品。应在常规操作条件之下进行确认,这一点很重要。EP15 指南使得实验室可以验证重复性条件下的精密度、中间精密度条件下的精密度以及正确度。我们并不建议同时进行这三实验方案,也不推荐一次验证实验室的所有方法。一般来说,我们会依次协助各个不同实验部门。初始结果的解释常由每个实验部门的员工、或负责这些部门的主管、或质量管理员来完成,他们都应能够理解和解释这些结果。
以下是我们发现的在应用 EP15 指南中最常出现的问题:
- 选择正确的样品用于精密度和正确度验证。
- 解释厂商在其手册或包装说明书中提供的信息。
- 使用上作表解释结果。
- 设备因维护不当或不足而出现重复性问题。
- 因错误解释检验程序的溯源性,导致正确度实验出现问题。
我们强调该实验方案是一个验证工具。我们强烈推荐实验室使用 EP15 实验方案得出的数据(偏移、CV)以及为检验程序选定的质量要求,并用总误差概念判断该检测是否满足临床用途要求的质量。
通过此种方法,实验室保证了检验程序的观测性能符合厂商声明的性能(公布在包装说明书和/或用户手册中),并表明性能满足该检测预期用途选定的质量要求。
在实施阶段,全体员工常会很有兴致参与其中,且能发现改进机会。也有可能采取纠正措施,及在实施改进(如维护或更换零件)之后对部分方法再做一次 EP15-A2 实验。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E4%B8%83%E7%AB%A0-%E5%A6%82%E4%BD%95%E5%9C%A8%E5%AE%9E%E9%99%85%E4%BD%9C%E4%B8%AD%E6%94%B9%E8%BF%9B%E8%B4%A8%E9%87%8F-part-2/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.