第十一章 何为 QC 的最低要求
目标
- 回顾 CLIA 规则中的管理内容
- 列出对非豁免检测的特殊 QC 要求
- 理解 CLIA 法规提供的 QC 选项
- 理解在不同认可组织下如何保证实施这些选项
问答
- 何为豁免项目和非豁免项目?
- 豁免项目要求的 QC 是什么?
- 非豁免项目的 3 个 QC 选项是什么?
- 认可本实验室的是哪家组织或机构?
- 哪些特殊 QC 要求对实验室有影响?
资料
State Operations Manual Appendix C - Survey Procedures and Interpretive
Guidelines for Laboratories and Laboratory Services
CLIA 法规要求的 QC
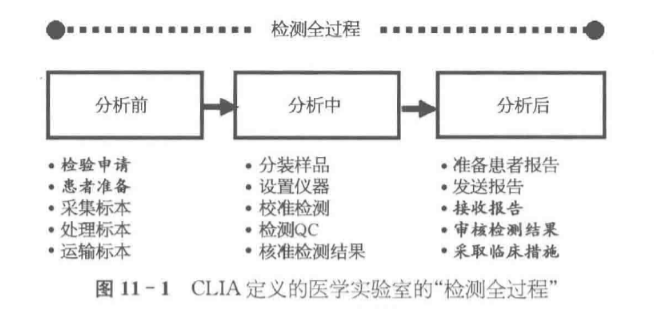
质量体系与检测全过程
—通用实验室体系
—分析前体系
—分析中体系
—分析后体系
**质量体系:**实施质量管理需要的组织、架构、资源、过程以及程序。
**过程:**将输入转为输出的相互关联或相互作用的一组的活动。
**程序:**为进行某项活动所规定的途径。
**质量评估:**确认,验证,评估,审核。
- 493.1250,检测系统,要求实验室满足如下要求:
- 493.1251 程序手册
- 493.1252 检测系统、设备、仪器、试剂、材料及供应
- 493.1253 建立与验证方法性能参数
- 493.1254 维护和功能检查
- 493.1255 校准和校准验证程序
- 493.1256 控制程序
- 493.1261~1278 专业及附属专业的要求
- 493.1281 比较检测结果
- 493.1282 纠正措施
- 493.1283 检测记录
- 493.1289 分析系统评估
QC 与检测的复杂性
豁免的检测项目
遵循厂家的指导,包括对 QC 的推荐或建议。
提供者进行的显微镜检查(PPM)
9 项 PPM 检测。
非豁免检测项目
§493. 1256 标准:控制程序
(a) 实验室有责任为每个检测系统建立控制程序,监控整个分析过程的准确度和精密度。
(b) 实验室必须建立控制品检测的次数、类型和频率等参数体系;若可用,应使用实验室按照 §493. 1253(b) (3) 的规定验证或建立的性能参数。
(c) 控制程序必须 (1) 立刻检出由于检测系统故障、环境条件不利及操作者行为发生的误差。 (2) 持续监控检测性能的准确度和精密度,是否因检测系统性能、环境条件及操作者行为变化等因素而受到影响。
(d) 除非是经 CMS 批准且列在国家操作手册 (CMS 第 7 版) 附录 C 中,确认可提供等效质量检测的程序,否则实验室必须:
(1) 按照本章规定执行控制程序。在§493.1261493.1278 条款的附加专业及附属专业要求中有其他规定的除外。
(2) 为每个检测系统进行控制程序时,使用厂商规定的数目和频率,或当满足或超过本节 (d) (3) 要求时由实验室自行建立。
(3) 每天进行患者标本检测或检查时,至少进行 1 次以下的控制程序:(i) 每个定量程序检测 2 个不同浓度的控制品;(i) 每个定性程序检测 1 个阴性和 1 个阳性控制品;
对于厂家指定使用替代的或电子控制或过程控制来满足日常 QC 要求的方法学,§493. 1256(d) 条款介绍了一种新的 QC 选项——等效质量检测。国家操作手册 (SOM) 的实验室及实验室服务法规与解读指南的附件 C 中提供了更多信息。
CAP 实验室认可计划的 QC 要求
CAP 原先的指导思想是:所有的临床实验室项目,不论属于哪一类 CMS 检测复杂度,原则上都需遵循同样的质量要求。现在,情况有了改变。CAP 为豁免检测提供了某些例外,新的 CAP 要求更接近 CLIA 对同类别的要求。实验室必须遵守 CAP 的实验室通用检查表(GEN, Laboratory General Checklist)中规定的质量要求,以及在各个检测特定领域检查表中规定的质量要求,如 POCT 检测检查表(POC)。 CAP 还要求主任或主任指定人员至少每月审核一次 QC 数据,从而发现长期趋势及不一致的情况。
其他实践标准
CLSI C24-2016 Statistical Quality Control for Quantitative Measurement Procedures
EP23-A Laboratory Quality Control Based on Risk Management; Approved Guideline
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%8D%81%E4%B8%80%E7%AB%A0-%E4%BD%95%E4%B8%BA-qc-%E7%9A%84%E6%9C%80%E4%BD%8E%E8%A6%81%E6%B1%82/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.