第三章 聚焦 ISO 15189 QMS 的要求
-
告知“做什么”,未告知“如何做”。
Do What, How to do.
-
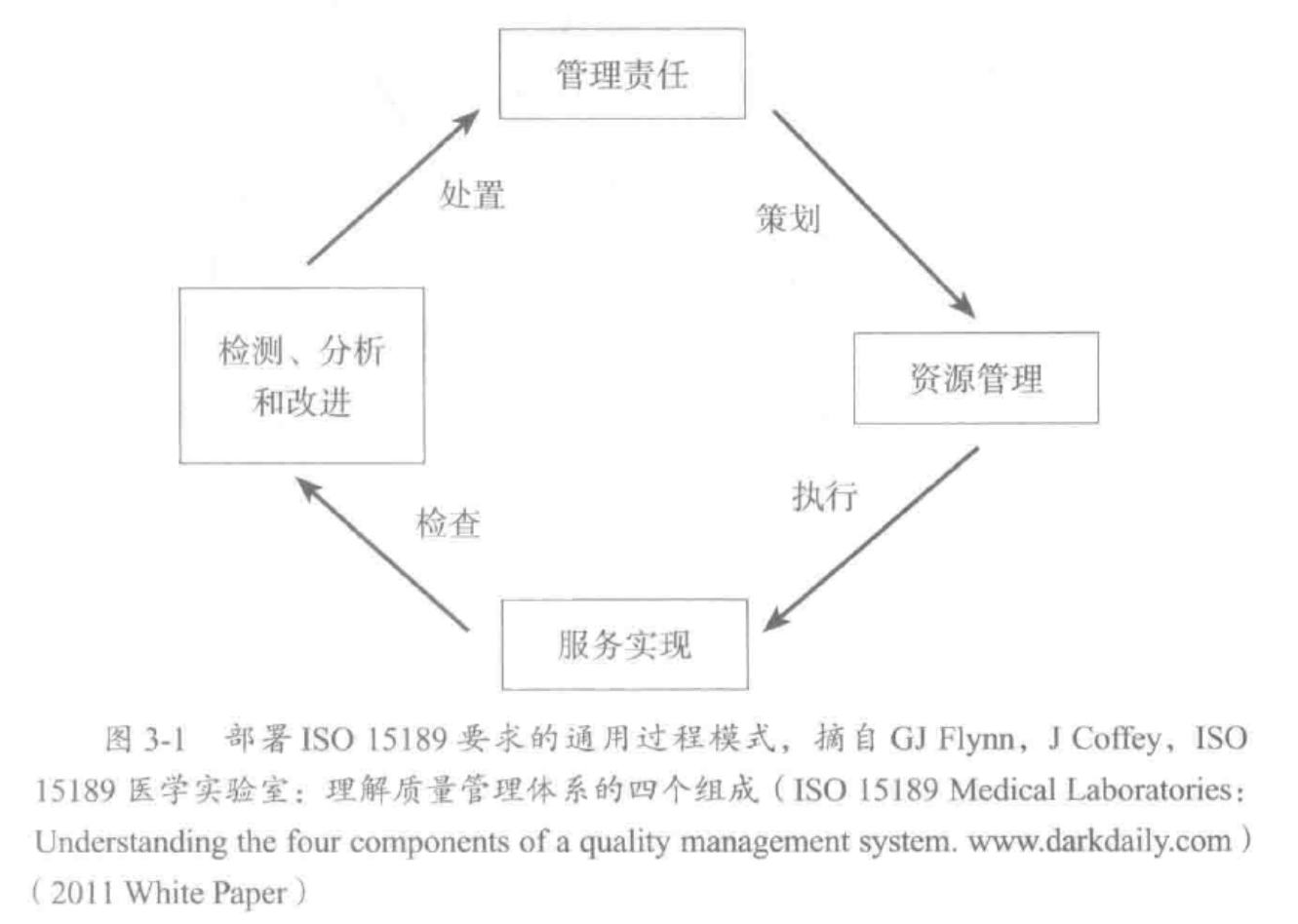
如何将 ISO 15189 要求与 Deming 的 “P-D-C-A”统一。
-
加拿大医疗质量管理研究院(IQMH)把这些要求分为四个部分:
-
管理责任;
-
资源管理;
-
服务实现;
-
检测、分析和改进;
“检测”改为“测量”较为合适。
-
-
部署
-
管理责任;
- 4.1 组织和管理责任
- 4.2 质量管理体系
- 4.3 文件控制
- 4.4 服务协议
- 4.5 受委托实验室的检验
- 4.6 外部服务和供应
- 4.7 咨询服务
- 4.13 记录控制
-
资源管理;
- 5.1 人员
- 5.2 设施和环境条件
- 5.3 实验室设备、试剂和耗材
-
服务实现;
- 5.4 检验前过程
- 5.5 检验中过程
- 5.6 检验结果质量的保证
- 5.7 检验后过程
- 5.8 结果报告
- 5.9 结果发布
- 5.10 实验室信息管理
-
检测、分析和改进;
- 4.8 投诉的解决
- 4.9 不符合项的识别和控制
- 4.10 纠正措施
- 4.11 预防措施
- 4.14 评估和内部审核
- 4.15 管理评审
-
理解
4.4 服务协议
实验室应制订文件化程序,用于建立和审核提供医学实验室服务的议。这样的协议应明确用户和客户的要求, 选用符合这些要求的检验程序,保证实验室具备必要的技能、专业知识和资源,以提供符合这些要求的服务。
4.5 受委托实验室的检验
实验室应制订文件化程序,用于选择与评估受委托实验室和对各学科的复杂检验提供意见和解释的顾问,即使实验室将样品交由外部实验室进行检测,实验室仍对标本的管理和将检测结果反馈给申请方负有责任。实验室有责任监督受委托实验室的质量,以保证恰当的报告格式、参考值、周转时间和结果解释。
第5.5.1.2和5.5.1.3节分别提供了检验程序验证和确认的特定指南。验证是证实厂商声明的性能,而确认是评估性能是否满足检验结果预期用途的要求。验证假设厂商进行了广泛的确认研究,因此实验室只需简单证实厂商声明的性能即可。如果实验室想要评价性能是否满足预期用途的要求,则适用确认。对于修改过的或实验室自行建立的方法,要求进行确认。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E4%B8%89%E7%AB%A0-%E8%81%9A%E7%84%A6-iso-15189-qms-%E7%9A%84%E8%A6%81%E6%B1%82/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.