第四章 法规对方法确认有何要求
目标:
- 根据 CLIA 的复杂度指南划分实验室检测的类别
- 将检测的复杂度类别与确认或验证实验室方法性能特性要求的实验研究相关联
- 比较法规和认可在方法确认要求上的异同
方法确认:法规要求
质量体系和检测全流程
CLIA 最终法规的核心是“质量体系”。CMS 列出了质量体系的如下关键部分:
- 一般实验室体系
- 分析前体系
- 分析中体系
- 分析后体系
保证实验室检测质量的流程称为质量评估,而不是此前版本中所称的质量保证或质量管理。
质量体系是指实施质量管理所需的组织、架构、资源、流程和程序。流程是指一种或多种将输入转为输出且相互关联的资源和/或活动。程序代表进行某种活动的特定方式。最终法规是围绕标本通过实验室的流程进行组织的。此流程称为“检测全流程”,包括了分析前、分析中和分析后过程和程序。
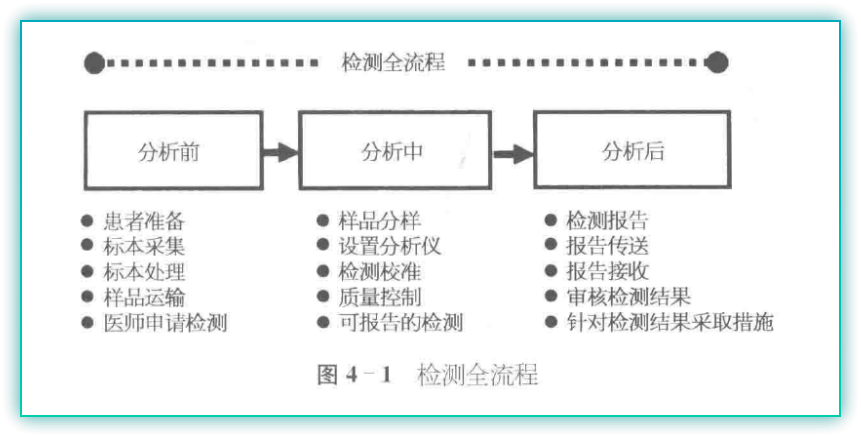
实验室检测质量控制的通用要求
亚章 K, 非豁免检测的质量体系
§493.1200(a) 每家进行非豁免检测的实验室,除了通用实验室体系之外,还须建立、维护实施和监控检测全流程(即分析前、分析中和分析后)所有环节质量体系的书面方针和程序。(b) 实验室质量体系必须包括一个质量评估部分,通过持续监控,识别、评价和解决问题,从而保证实验室性能和服务的持续改进。(c) 实验室质量体系的不同部分被用来满足此部分的要求,且必须适合实验室从事检测的专业和亚专业、提供的服务及服务的客户。
§493.1250 分析系统,要求实验室满足如下要求: §493.1251 程序手册 §493.1252 检测系统、设备、仪器、试剂、物料和供应 §493.1253 建立和验证性能参数 §493.1254 维护和功能检查 §493.1255 校准和校准验证程序 §493.1256 控制程序 §493.1261~1278 专业和亚专业要求 §493.1281 检测结果比对 §493.1282 纠正措施 §493.1283 检测记录 §493.1289 分析系统评估
方法确认和检测复杂度
- 豁免检测
- FDA 批准的,非豁免检测
§493.1253 建立和验证性能参数 (a) 适用范围。实验室无须为 2003 年 4 月 24 日前启用的检测系统验证或建立性能参数。 (b)(1) 验证性能参数。实验室引进的经 FDA 批准且未做任何修改的检测系统,必须在报告患者检测结果之前进行如下工作:
(i) 证明检测系统可以取得与厂商建立的如下性能特性可比较的性能参数: (A) 准确度。 (B) 精密度。 (C) 可报告范围。 (ii) 验证厂商的参考区间(正常值)适用于实验室的患者群体。
这通常意味着需要进行以下四个实验:
- 方法比对实验估计不准确度或偏移。
- 重复性实验估计不精密度。
- 线性实验确定可报告范围。
- 收集参考值验证参考范围。(或者,由实验室医学主任书面确认厂商或教科书提供的参考范围适用于服务的客户群。)
修改的非豁免检测或自建检测项目
如果检测方修改了中等复杂度检测,或使用了自建的或属于高等复杂度的检测,根据 CLIA 的规定,必须根据如下要求执行更严格的方法确认:§493.1263(b)(2) 实验室若修改了 FDA 批准的检测系统,或使用了未经 FDA 批准的检测系统(包括实验室自建方法和教科书程序、革兰染色或氢氧化钾制备等),或使用了厂商未提供性能参数的检测系统,在报告患者检测结果之前,必须为每个检测系统建立如下性能特性(若适用)的性能参数:
(i) 准确度。
(ii) 精密度。
(iii) 分析灵敏度。
(iv) 包含干扰物的分析特异性。
(v) 检测系统测结果的可报告范围
(vi) 参考区间(正常值)。
(vii) 检测性能要求的任何其他性能特性。
(3) 基于根据本章 (b)(1) 或 (b)(2) 小节验证或建立的性能参数,参照§493,1255 和§493,1256 的要求为患者检测确定检测系统的校准和控制程序。
要进行以下七个不同的实验:
- 方法比对实验估计不准确度或偏移。
- 重复性实验估计不精密度。
- 线性实验确定可报告范围。
- 检出限实验估汁可以被检出的最低浓度。
- 干扰实验确定恒定干扰。
- 回收实验确定比例干扰。
- 全面的参考值研究估计参考范围。
必须用文件记录这些研究实验, §493,1253(c)要求实验室将方法确认文件至少保存至该方法停用为止。
对校准和校准验证的特别规定
§493.1255(a) 执行和记录校准程序
(1) 参照厂商的检测系统说明,用厂商提供或指定的校准品,频率不低于厂商推荐。
(2) 使用实验室根据 493.1253(b)(3) 的规定验证或建立的标准:
(i) 使用适用于检测系统的校准品,最好能溯源至参考方法或具有已知值的参考物质。
(ii) 包含校准品的个数、类型和浓度,以及校准的可接受限和频率。
(3) 每当校准验证超出实验室的校准验证可接受限时。
总之,实验室必须遵循厂商的校准要求,根据厂商推荐的频率重新校准,并在校准验证失败时重新校准。
校准验证
此过程验证校准是否保持稳定。在许多方式上,此程序在操作上与可报告范围验证实验频为相似。具体要求如下:
§493.1255(b) 执行和记录校准验证程序
(1) 遵循厂商的校准验证说明。
(2) 使用实验室根据§493.1253(b)(3) 的规定验证或建立的标准:
- (i) 包含样品的个数、类型和浓度,以及校准验证的可接受限。
- (ii) 至少包含一个最低(零)值、一个中间值和一个接近范围上限的最大值,以验证检测系统检测结果的实验室可报告范围。
(3) 至少每 6 个月一次,或当以下任意一项发生时:
- (i) 彻底更换了检测程序的试剂,除非实验室可以证明更换试剂批号没有影响用于患者检测结果的范围,同时对控制值也未产生不利影响。
- (ⅱ) 进行了可能影响检测性能的重大预防性维护或更换了关键零部件。
- (iii) 控制品结果反映异常趋势或漂移,或超出了实验室可接受限,且其他评估和纠正失控数据的方法未能找出和纠正问题。
- (ⅴ) 实验室为验证患者检测结果的可报告范围建立的计划要求更高频率进行校准验证。
对定期确认的附加要求
最后,对于某些检测项目,根据如下两条要求,可能需要进行附加的方法确认实验。
-
对于未经能力验证计划评价的任何检测项目,要求持续(至少每 6 个月)评估其准确度。
§493.1236 能力验证性能评价。(c) 实验室必须对符合如下情况的检测验证其准确度,至少每年 2 次:(1) 未列入本部分 I 亚章,且未经 CMS 批准的能力验证计划评价或评分的任何检测或程序:(2) 列入了本部分 I 亚章,但 CMS 批准的能力验证计划未提供适用的能力验证样品的任何检测或程序。
-
在多个分析系统上进行检测的项目,要求定期进行如下比对:
§493.1281 检测结果比对。(a) 如果实验室检测系统项目使用不同方法学或仪器,或者在多个地点进行同样项目的检测,实验室必须建立一套体系,每年 2 次评估和确定使用不同方法学、仪器或在不同检测地点的检测结果之间的关系。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E5%9B%9B%E7%AB%A0-%E6%B3%95%E8%A7%84%E5%AF%B9%E6%96%B9%E6%B3%95%E7%A1%AE%E8%AE%A4%E6%9C%89%E4%BD%95%E8%A6%81%E6%B1%82/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.