第二十章 如何以西格玛度量评价厂商声明
把声明的性能转换成西格玛度量值,这个方法足够好吗?
- 世界级质量目标: $$ TE = bias + 6s \tag 1 $$
- 最低要求: $$ TE = bias + 3s \tag 2 $$
六西格玛原理要追溯到 Motorola 在 20 世纪提出的 TQM 做法。Motorola 当时建立了一个目标:过程变异的六西格玛或 6 倍标准差应在过程允许限值之内,因此将其称为六西格玛。
六西格玛的强大之处在于它是一个以“西格玛度量”衡量过程性能的普遍标准,大大促进了行业间质量基准。
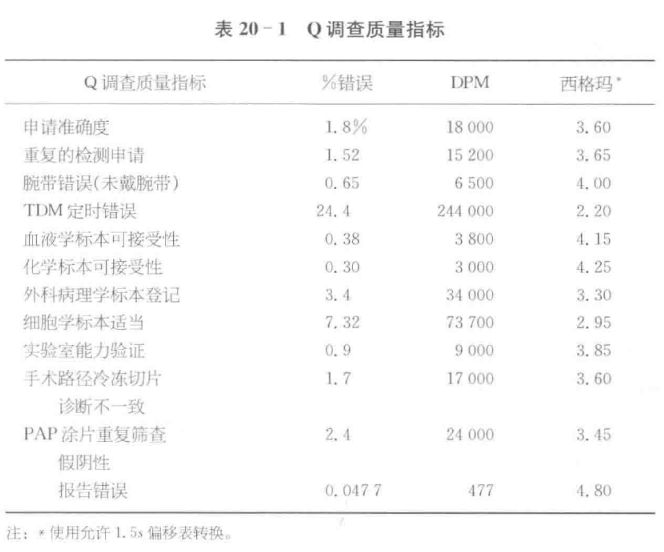
六西格玛方法学可应用于任何可测量的过程结果。许多过程的不良结果可作为差错或缺陷计数,以每百万缺陷率 (DPM) 表示,然后用可从任何六西格玛教科书中取得的标准表将其转换为西格玛度量值。目前,医疗保健机构正高度重视医疗服务的效果,六西格玛为其提供了方法学,以易于理解的定量词语描述性能。
度量检测过程性能的两个方法
- 计算过程产生的缺陷数(后果测量);
- 计算过程变异(预测测量)。
第一个方法(后果测量)广泛应用于工业和医疗领域,对过程产生的缺陷个数进行计数,以每百万缺陷率估计缺陷率,然后用标准转换表将其转换为西格玛度量值。
只要估计了一个错误率,就能用这个方法学将错误率转换为西格玛度量值。此方法可方便地应用于实验室的分析前和分析后过程。
问题:
对于实验室检测,很难用缺陷计数的方法来确定六西格玛性能。问题在检测结果缺陷的定义上:
- 当某个检测结果与它的真值不一致时可以算作缺陷么(以及在只检测一次的情况下如何确定患者标本的真值)?或者
- 只有当检测结果超出了 2 控制限时才可算作缺陷?
- 是否需要超出其他控制限?
- 是否必须超出总允许误差?
- 还是必须导致一个医疗差错?或是必须导致死亡?
对于多数实验室,如果沿用习惯的 2s 控制限,将得到一个错误的缺陷计数结果,据此计算的是一个错误的西格玛度量值。
分析过程的质量评估
基于西格玛度量,很容易评估分析检测过程的性能。最大允许限值(质量要求)可来自 CLIA 能力验证标准或其他恰当来源:过程变异和偏移可来自方法确认实验、对等比较数据、能力验证结果乃至常规 QC 数据的估计。
需要从方法确认实验中取得如下数据:
- 重复性实验结果 (CV)。
- 方法比较实验结果(斜率、y 轴截距和)。
需要从其他来源获取如下信息:
- 质量要求 (CLIA、临床、生物或其他)。
- 医学决定水平(以确定临界水平)。为计算西格玛度量值,以质量要求减去方法的观测偏移,然后除以方法的 SD 或 CV, 等式如下:
$$ \text{方法西格玛值} = (CLIA ; TE_a - \mbox{方法偏移})/方法 CV $$
通用指南
- 找到厂商精密度和偏移的声明,留意精密度声明所在浓度。
- 规定你和你实验室要求的决定水平。
- 规定要求的决定水平的质量要求。
- 直接使用最接近要求的决定水平的 CV 声明,或当决定水平位于厂商所用控制品浓度之间时,计算声明 CV 的均值;或当你的决定水平较接近其中一个厂商 CV 限时,在厂商声明的 CV 中插人一个合理的 CV 值。为安全起见,也可使用厂商声明的最高 CV。
- 计算你的决定水平的偏移。
- 计算西格玛度量值。
- 若有 2 个或 2 个以上决定水平,比较西格玛度量值,确定何者对患者的诊疗更重要。
科学判断在选择正确数值纳入计算上扮演重要角色。厂商通常声明批内和总精密度。使用总精密度虽会得出较低的西格玛度量值,但更能代表实验室的长期性能。厂商还可能提供相对于 2 个或更多比较方法的偏移声明,应选择与自己的方法最接近的比较方法。
西格玛的影响
西格玛度量值将检测的质量要求和方法的观测精密度和偏移整合成了一个数字。它将方法性能置于一个单一尺度之下,不考虑具体的检测。该尺度是一个跨行业且已被广泛接受的质量尺度一目标是 6.0 西格玛,最低可接受限为 3.0 西格玛。
可以方便地确定某个方法所需的性能。例如:假设 CLIA 标准的可接受性能为 10%,方法需要达到 CV 为 1.7%和偏移 (bias) 为 0.0%,[(10 一 0.0)/6=1.7],方能实现六西格玛质量。
让人疑惑的是,为何美国国家胆固醇教育计划 (CEP) 专家制定的指南建议最大允许 CV 和偏移均为 3.0%?按照 CLIA 标准的可接受性能,这样的胆固醇方法只能达到 2.33 西格玛 [(10 一 3)/3]。
对任何行业,都不应将低于 3.0 西格玛能力的过程用于常规生产或应用。通过这一示例,可以体会六西格玛的概念和原理如何影响我们理解过程性能和改变我们对检测方法设定的目标和指标。
- Author: Jim Wong
- Link: http://qms.atotoro.cn/post/%E7%AC%AC%E4%BA%8C%E5%8D%81%E7%AB%A0-%E5%A6%82%E4%BD%95%E4%BB%A5%E8%A5%BF%E6%A0%BC%E7%8E%9B%E5%BA%A6%E9%87%8F%E8%AF%84%E4%BB%B7%E5%8E%82%E5%95%86%E5%A3%B0%E6%98%8E/
- License: This work is under a 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议. Kindly fulfill the requirements of the aforementioned License when adapting or creating a derivative of this work.